
2025.04.09
【蓄電池の電解液と雑学】
産業用蓄電池の電解液+αの内容となります。
専門的な要素が含まれていますが、研究機関ではないので、難解な質問はご容赦願います!
鉛蓄電池
希硫酸『ベント式据置鉛蓄電池(濃度約30%)』
『制御弁式据置鉛蓄電池(濃度35~45%)』
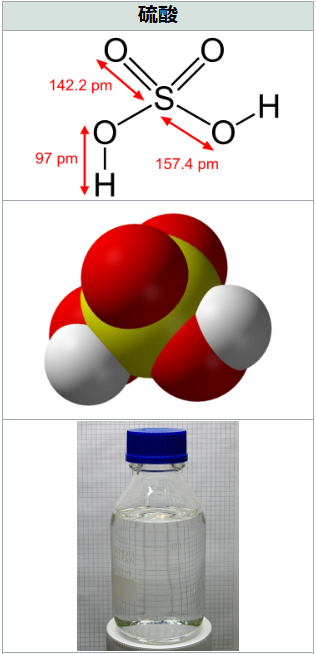
分子式:H₂SO₄
色:無色透明
臭い:無臭(常温)
引火点:なし(不燃性)
pH:1以下
特別管理産業廃棄物の種類:廃酸
『著しい腐食性を有するもの(pH2.0以下のもの)』に該当
アルカリ蓄電池(ニッケル・カドミウムアルカリ蓄電池)
水酸化カリウム溶液(濃度約48%)+ 水酸化リチウム添加
分子式:KOH + LiOH
色:無色透明
臭い:無臭
引火点:なし(不燃性)
pH:14以上
特別管理産業廃棄物の種類:廃アルカリ
『著しい腐食性を有するもの(pH12.5以上のもの)』に該当

リチウムイオン電池
非水系電解液(添加剤含め、電解液のノウハウは各社非公表のため、一般的な内容を記載します)
引火点:40℃程度(第4類第二石油類に該当)
電解質(従来タイプ):六フッ化リン酸リチウム(ヘキサフルオロリン酸リチウム)
分子式:LiPF₆
外観:白色結晶
臭い:無臭
引火点:なし(不燃性)

電解質(新タイプ):LiFSI リチウムビス(フルオロスルホニル)イミド
外観:白色粉末
臭い:無臭

溶媒:エチレンカーボネート(EC)
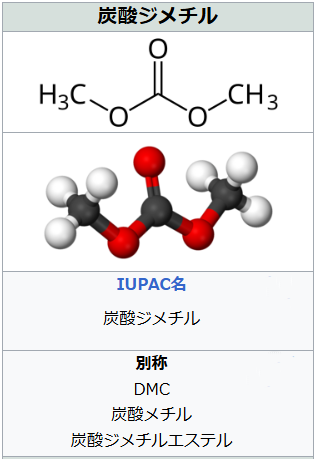
ジメチルカーボネート(DMC)
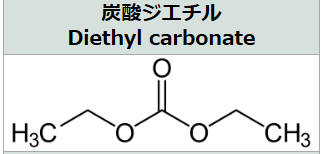
ジエチルカーボネート(DEC)
エチルメチルカーボネート(EMC)等の混合溶媒
【雑学TIME】
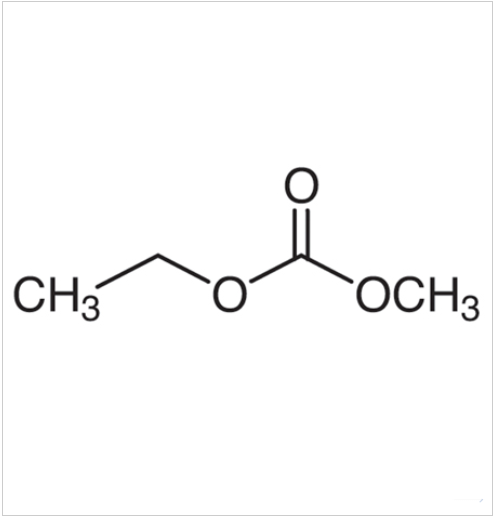
【pH】水素イオン指数
国際単位系にて1957年から英語読みの「ピーエイチ」に統一。
日本ではドイツ語読みである「ペーハー」が定着していましたが、2012年の教科書から「ピーエイチ」読みに統一。
溶液の酸と塩基の程度を表す物理量で1909年にデンマークの生化学者であるセーレン・セーレンセンが提案。
室温の水溶液では、水溶液のpHが7より小さい時は酸性、7より大きい時はアルカリ性、7付近の時は中性。(温度によって水溶液の中性のpH値が変化します。)
pHが小さいほど、水素イオン濃度は高い。
pHが1減少すると水素イオン濃度は10分の1になる。
酸性の原因は水素イオン(pHが中性の時の値よりも小さくなればなるほど酸性が強くなる。)
アルカリ性の原因は水酸化物イオン
水溶液の水素イオン濃度が10分の1になると、水酸化物イオンの濃度は10倍になるので、pHが中性の時の値よりも大きくなればなるほどアルカリ性が強くなる。
市販されているpHメーターで測定可能なpH範囲は通常、0~14まで、あるいはそれよりも狭い範囲に限られます。
pHに下限や上限は特に存在せず、負の値や14を超過する値も取り得ます。
実際に鉛蓄電池の電解液のpHは負の値であり、アルカリ蓄電池の電解液のpHは14を超過します。
このような濃厚水溶液の酸性やアルカリ性の強さは酸度関数によって表現する事が一般的です。
【酸度関数】
高濃度溶液、混合溶媒系、超酸等、水素イオン指数(pH)が適用できない場合に用いられ、幾つかの種類があります。
『ハメットの酸度関数Ho』
酸について用いられる(アメリカの物理化学者であるルイス・ハメットによって提唱)
対象となる溶液の種類と組成、濃度に固有の数値で温度によって変化。
Hoの値は強い酸性であるほど負に大きな数値となります。
『超酸』
100%硫酸よりも酸性が強い酸の総称
多くの超酸は2種類以上の化合物の組み合わせにより、高い酸性を実現しています。
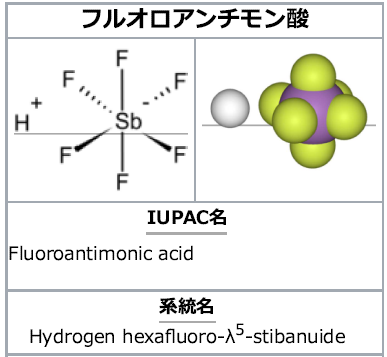
現在までに最も強い超酸
フルオロアンチモン酸:フッ化水素(HF)と五フッ化アンチモン(SbF₅)との化合物
化学式:HF₆Sb
外観:無色液体
用途:化学品製造における触媒、高機能材料の合成、高オクタン価燃料の生成など
Ho値= -31.3 ⇒ 100%硫酸より2×10¹⁹(2000京)倍強い。

容器:PTFE(ポリテトラフルオロエチレン) ⇒ デュポン(Du Pont) 『Teflon®』
炭素原子とフッ素原紙が結合したものが直鎖的につながった分子構造
炭素原子同士の結合部はフッ素原子で隙間なく覆われることで、フッ素原子によって保護されています。
『塩基の酸度関数』
塩基性の尺度にはハメットの酸度関数を塩基に置換した形式の酸度関数H_が使用されます。
☆塩基度関数という語は使用されません。
H_は強い塩基性であるほど、正に大きな数値となります。
【蓄電池の起電力】
蓄電池の起電力は正極電位と負極電位の電位差で決まります。
それぞれの電位は水素電極との電位差で決まっており、これを『標準電極電位差』といいます。
『鉛蓄電池の起電力』1.68V - (-0.36V)=2.04V
正極電位 負極電位
[鉛蓄電池の起電力における硫酸濃度の影響]
鉛蓄電池の起電力は電解液比重に影響を受けます。
電解液比重と回路電圧には高い相関がある事が判明しており、通常使用する範囲では以下の関係が成立します。
鉛蓄電池の回路電圧 = 電解液比重 + 0.84
『アルカリ蓄電池の起電力』0.52V -(-0.80V)=1.32V
正極電位 負極電位
【おわりに】
蓄電池は電気製品であると共に、化学製品の要素が高く、その『電解液』や+α【雑学】の記事は専門的+マニアックな内容となりました。
蓄電池を短絡させてしまうと、瞬時に大電流が発生し、火傷や失明等の大けがをする危険性が広く知られていますが、蓄電池の電解液は有害性が高く、特別管理産業廃棄物に該当するため、取扱に注意が必要であることを周知したいと考え記事にしました。
少しでも蓄電池や非常用電源等の社会インフラに関心がある方やこの記事で興味が沸いた方は蓄電池業界に携わる事をお勧めします。
当社TECS事業部はそのような好奇心旺盛な方には特に良い職場ですので、ご一考いただけると幸いです。
蓄電池設備のお問い合わせは東亜電機工業株式会社 TECS事業部まで、お気軽にご連絡ください。
お問い合わせ
省エネ、防災、減災など安心の電源設備に関するお困りごと、課題解決はお気軽にご相談ください。
安⼼な電源設備をあなたのもとへに関する資料はこちら関連ページ

安⼼な電源設備をあなたのもとへ
産業⽤蓄電池や発電システムなど安⼼の電源設備を、設計・施⼯から保守まで⼀貫して提供します
この記事はTECS事業部が執筆しました。
関連記事
おすすめ記事

GSユアサの工場で、お客様自身による立会検査が可能です

作業員全員、蓄電池設備整備資格者!

福井の皆様へ 新たな電源ラインナップを越前がにと共に
人気記事

蓄電池設備の消防法令改正を解説します!
一次電池と二次電池の違いについて

触媒栓って何?いつ交換するの?
蓄電池銘板のセルと個数の関係について解説(注意!)

直流電源装置の整流器容量選定について

直流電源装置って何に使うの??

蓄電池設備には標識設置基準があることをご存じですか?

非常用発電機設置には関係官公庁への届け出が必要です!

バッテリー液が流出!?もしもの時に備えて中和講習!













